消化道早癌内镜诊治规范(讨论版)
发布人:系统管理员 发布日期:2019-04-14 点击:次
一、诊断规范:
(一)消化内镜检查:
1.检查前准备:
(1)胃镜:患者禁饮食8小时以上,检查前常规服用咽部麻醉剂及消泡剂(二甲基硅油),如果行染色内镜术前同时口服去粘液剂(链霉蛋白酶)。如无上述产品检查时如有泡沫、粘液一定要用二甲基硅油生理盐水冲洗干净。推荐有条件单位推广无痛胃镜检查,不仅减少患者痛苦,还能提高检查质量。
(2)结肠镜:检查前一天少渣饮食,检查当天口服泻药,推荐应用聚乙二醇电解质溶液或硫酸镁做肠道准备,肠道准备时间为4小时,多让患者活动。如检查时肠腔内残存粪质和泡沫,尽量用二甲基硅油生理盐水冲洗干净。检查前如无禁忌症常规应用解痉剂如丁溴东莨菪碱。
2.胃镜检查规范:进镜前检查内镜是否正常,是否打开工作站,核对患者信息。如有NBI功能,用NBI进镜,观察咽部、食管,至贲门调为白光,如患者反应较大,进镜观察咽部困难,可在检查结束退镜至咽部时观察,常规留取咽部声门照片。胃镜检查时充分注气,手法轻柔,避免盲区,尤其是胃体小弯侧近贲门、贲门粘膜嵴、胃体中部小弯、胃角前后壁等,十二指肠注意球部后壁及降段乳头。胃镜至少要采集35张左右白光照片,包括口咽部1张、食管4张、贲门胃底4张、胃体14张、胃角3张、胃窦5张、十二指肠球部2张、降段2张、取活检部位2张。具有NBI功能胃镜加咽部及食管5张。
3.结肠镜检查规范:进镜前检查内镜是否正常,是否打开工作站,核对患者信息。结肠镜检查推荐单人操作,进镜至盲肠后充分注气,清洁视野,缓慢退镜观察,遇到弯曲时缓慢通过,必要时对同一部位反复进镜、退镜观察,退镜观察时间不少于6分钟。如进镜过程中发现小于5毫米息肉,可先行活检后再继续进镜。结肠镜照片数量无严格限制,但应该在20张以上,对每段结肠都应留取照片,如回肠末端、阑尾开口、回盲瓣、回盲部远景、升结肠、肝曲、横结肠、脾区、降结肠、乙状结肠、直肠、肛管及直肠倒镜。
4.可疑病变内镜检查规范:
(1)白光内镜:如果发现可疑早癌病变,先用白光内镜把病变的远景、近景、直视、侧视、充气状态、吸气后照片留取,照片图像要求清晰,病变部位位于图像中央,内镜前端与观察部位距离适当。
(2)电子染色内镜:因电子染色本身不会对病变造成任何影响,因此白光观察后先用电子染色观察,主要是近景观察,如病变较大时要全面观察病变,尤其要注意病变的边缘、明显隆起及凹陷处,分别留取各位置照片。结合放大内镜观察时,先非放大状态观察完毕后,再用低倍放大观察,后逐步增加放大倍数,直至最高倍放大,在逐步调整、增加放大倍数时一定要注意观察病变最严重位置,留取各放大倍数及位置照片。放大内镜观察时因可能对病变造成摩擦、损伤,因此对胃和结肠可以在染色内镜观察后再进行放大内镜观察,但食管碘染后难以放大观察,所以食管须先放大内镜观察再碘染。
(3)染色内镜:应用特殊染料使消化道黏膜结构更加清晰,加强病变部位与周围黏膜的对比。常用染色剂有靛胭脂,浓度0.5%;复方碘(卢戈氏液),浓度1.5%;冰醋酸,浓度1.5%;结晶紫,浓度0.05%。
①复方碘在染色内镜中主要用于对食管黏膜的染色。正常食管黏膜鳞状上皮中糖原丰富,遇碘呈棕色,当黏膜发生恶变时,其中糖原的含量发生变化,使染色后食管呈现深着色、浅着色、不着色等情况。染色前冲洗掉食管表面粘液,用花洒式喷洒管沿齿状线喷洒至距门齿20CM,立即吸引抽出食管腔内残留碘剂,后用少量生理盐水冲洗食管,胃镜进入胃内吸引抽出胃底残余碘剂,后退镜观察。
②靛胭脂为非黏膜吸收染色剂,其采用力学原理,即低凹部位色素潴留,较为凸起的部分色素消退较快来进行对比,观察其在黏膜间隙的分布情况显示黏膜微细变化和病灶立体结构,补充肉眼观察的不足。用直喷式喷洒管对准病变缓慢喷洒,如病变边缘不清要扩大喷洒范围,后吸气,等待2-3分钟后充气观察。
③冰醋酸刺激黏膜血管收缩,喷洒后黏膜变白,腺管结构更加清晰,肿瘤组织由于血管丰富,会比正常黏膜更早恢复血供而比周围组织发红,内镜下容易识别。用直喷式喷洒管对准病变缓慢喷洒,如病变边缘不清要扩大喷洒范围,喷洒时记录喷洒时间,持续观察病变处3分钟左右,记录病变颜色变化及时间。
④结晶紫可以被肠道上皮细胞吸收,而腺管开口处无染色剂,能凸显腺管结构。用直喷式喷洒管对准病变缓慢喷洒,如病变边缘不清要扩大喷洒范围,后吸气,染色后2分钟左右观察腺管开口形态。
(二)消化内镜诊断:
1.病变部位
2.病变大体形态,巴黎标准
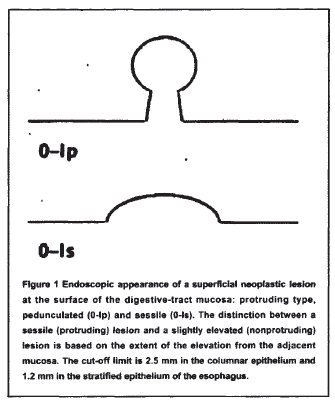
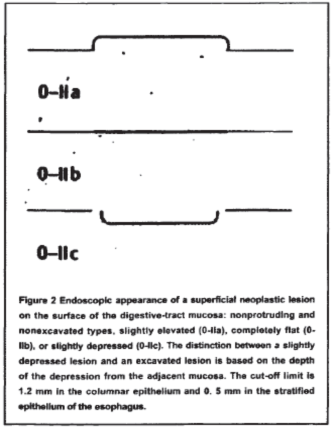
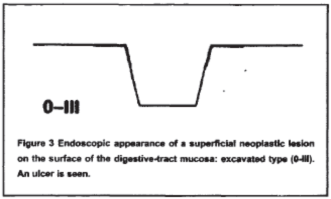

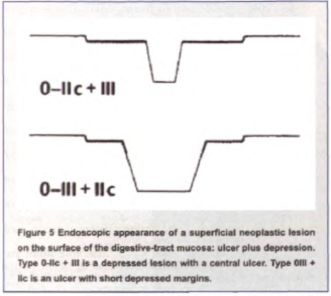
3.病变大小
4.病变类型,结合染色、电子染色、放大内镜等方法,初步判断性质(鳞癌、腺癌)、分化程度、浸润深度
5.病变TNM分期,结合超声内镜(N)及超声小探头(T)
二、治疗规范:
(一)内镜治疗适应证
1.食管早癌内镜治疗适应证:
EMR适应证:小于15mm的食管高级别上皮内瘤变。
ESD适应证:①大于15mm的食管高级别上皮内瘤变。②早期食管癌:结合染色、放大和超声内镜(EUS)等检查,确定病变的范围和浸润深度,局限于m1、m2、m3或sm1且临床没有血管和淋巴管侵犯证据的高、中分化鳞癌。③伴有不典型增生和癌变的Barrett食管。④姑息性治疗,适于侵犯深度超过sm1、低分化食管癌、心肺功能较差不能耐受手术的高龄患者及拒绝手术者,并需结合放疗。
2.胃早癌内镜治疗适应证:
EMR适应证:小于10mm的胃高级别上皮内瘤变及分化型粘膜内癌。
ESD适应证:①不论病灶大小,无合并溃疡存在的分化型黏膜内癌。②肿瘤直径≤30mm,合并溃疡存在的分化型黏膜内癌。③肿瘤直径≤30mm,无合并溃疡存在的分化型sm1黏膜下癌。④肿瘤直径≤20mm,无合并溃疡存在的未分化型黏膜内癌。⑤大于20mm的胃黏膜上皮内高级别瘤变。⑥EMR术后复发、再次行EMR困难的黏膜病变。⑦高龄、有手术禁忌证或疑有淋巴结转移的黏膜下癌,拒绝手术者可视为ESD相对适应证。
3.结肠早癌内镜治疗适应证:
EMR适应证:小于20mm的腺瘤和结肠直肠早期癌症。
ESD适应证:①无法通过EMR实现整块切除的>20mm腺瘤和结肠直肠早期癌症。术前需通过抬举征、放大内镜或EUS评估是否可切除。②抬举征阴性的腺瘤和早期结肠直肠癌。③大于10mm的EMR残留或复发病变,再次EMR切除困难的病变。④反复活检仍不能证实为癌的低位直肠病变。
(二)内镜治疗禁忌证:严重的心肺疾病、血液病、凝血功能障碍及服用抗凝剂的患者,在凝血功能未纠正前严禁行ESD。病变浸润深度超过sm1则为ESD的相对禁忌证。
(三)ESD操作规范:
1.确定病变范围和深度
ESD 操作时首先进行常规内镜检查,了解病灶的部位、大小、形态,结合染色和放大内镜检查,确定病灶的范围、性质和浸润深度。
2.标记
确定病变范围后,距病灶边缘约3-5mm 处进行电凝标记,标记点间距3mm。对于上消化道病变常规进行标记,而对于界限清晰的下消化道病灶,可不标记。
3.黏膜下注射
注射液体有生理盐水(含少量肾上腺素和靛胭脂,肾上腺素体积分数约为0.005‰)、甘油果糖、透明质酸钠等。于病灶边缘标记点外侧进行多点黏膜下注射,将病灶抬起,与肌层分离,有利于ESD完整地切除病灶,不易损伤固有肌层,从而减少穿孔和出血等并发症的发生。
4.切开
沿标记点或标记点外侧缘切开病变周围部分黏膜,再深入切开处黏膜下层切开周围全部黏膜。首先切开的部位一般为病变的远侧端,如切除困难可使用翻转内镜的方法。切开过程中一旦发生出血,应冲洗创面明确出血点后采用电凝止血。
5.黏膜下剥离
在进行剥离前,要判断病灶的抬举情况。随着时间的延长,黏膜下注射的液体会被逐渐吸收,必要时反复进行黏膜下注射。术中反复黏膜下注射可维持病灶的充分抬举,按照病灶具体情况选择合适的治疗内镜和附件。如在剥离过程中,肿瘤暴露始终很困难,视野不清,可利用透明帽推开黏膜下层结缔组织,以便更好地显露剥离视野。根据不同的病变部位和术者的操作习惯,选择不同的刀具进行黏膜下剥离。剥离中可通过拉镜或旋镜沿病变基底切线方向进行剥离,还可根据不同需要改变体位,利用重力影响,使病变组织受到自重牵引垂挂,改善 ESD 的操作视野,便于切开及剥离。
6.创面处理
病变剥离后,对创面上所有可见血管进行预防性止血处理;对可能发生渗血部位以止血钳、氩离子血浆凝固术(argon plasma coagulation, APC)等治疗,必要时可用金属夹夹闭;对于局部剥离较深、肌层有裂隙者,应行金属夹夹闭。
7.术中并发症的处理
术中出血可使用各种切开刀、止血钳或金属夹等治疗,剥离过程中对发现裸露的血管进行预防性止血,预防出血比止血更重要。对于较小的黏膜下层血管,可用各种切开刀或APC直接电凝;对于较粗的血管,用止血钳钳夹后电凝。黏膜剥离过程中一旦发生出血,可用冰生理盐水(含去甲肾上腺素)冲洗创面,明确出血点后可用APC或止血钳钳夹出血点电凝止血,但APC对动脉性出血往往无效。上述止血方法如不成功,可采用金属夹夹闭出血点,但往往影响后续的黏膜下剥离操作。术中一旦发生穿孔,可用金属夹缝合裂口后继续剥离病变,也可先行剥离再缝合裂口。由于ESD操作时间较长,消化道内积聚大量气体,压力较高,有时较小的肌层裂伤也会造成穿孔,因此ESD过程中必须时刻注意抽吸消化道腔内气体。
8.术后处理
(1)操作报告:操作完毕后,术者应及时书写操作报告,详细描述治疗过程中的发现,全面叙述所采取的治疗方法、步骤及其初步结果;如有必要,还需要记录操作中出现异常情况、可能发生的并发症及其处理建议。 操作者应及时为经治医师提供完整的书面报告,医疗文书应按规定存档管理。
(2)复苏和观察:采用深度镇静或麻醉的患者应按规定予以复苏,建议在专设的复苏区由专人照看,密切监察生命体征,直至患者意识清醒。患者转出前应交待相应注意事项。
(3)并发症的防治:操作后第一个24h是并发症最易发生的时段,应密切观察患者的症状及体征变化,手术当日应禁食、静脉补液,以后根据病情逐步恢复饮食,上消化道疾病患者可给予质子泵抑制剂。如有不明原因的胸、腹痛,应及时行胸腹透视、超声或 CT 检查;怀疑创面出血,建议尽早行内镜介入,寻找出血部位并给予止血处理;术中并发穿孔时,吸净消化管腔内的气体和液体,内镜下及时闭合穿孔,术后胃肠减压,予禁食、抗炎等治疗,严密观察胸、腹部体征;保守治疗无效者(一般情况变差、体温升高、腹痛程度加剧、范围扩大等)则应立即行外科手术治疗(建议有条件者,行腹腔镜探查修补穿孔)。
(4)术后抗生素和止血药的应用:ESD术后应用抗生素的目的主要在于预防手术创面周围的纵隔、后腹膜或游离腹腔的感染及术后可能发生的全身性感染,特别是手术范围过大、操作时间较长、反复进行黏膜下注射导致周围炎症水肿者,或可能并发消化道穿孔者。对于术前评估ESD范围大、操作时间长、可能引起消化道穿孔者,特别是结肠直肠病变行ESD者,可考虑预防性使用抗生素。药物的选择参照卫生部抗菌素使用原则,上消化道ESD选用第一、二代头孢菌素,结肠直肠ESD选用第二代头孢菌素(头孢曲松或头孢噻肟),可加用甲硝唑。 术后用药总时间不应超过72h,但对于有穿孔、大量出血、高龄患者及免疫缺陷人群,可酌情延长。ESD术后可酌情使用止血药物。
(四)治疗后随访:癌前病变患者在行ESD后按以下时间节点行内镜随访。术后第1年及第 2年各行内镜检查1次,以后每3年1次连续随访。早期癌症内镜治疗后,术后3、6、12 个月定期内镜随访,并行肿瘤指标和相关影像学检查。 无残留或复发者以后每年 1 次连续随访,有残留或复发者视情况继续行内镜下治疗或追加外科手术切除,每3个月随访1次,病变完全清除后每年1次连续随访。
消化病理标本处理及诊断规范
消化道早癌的诊断病理医生与内镜医生的密切合作和沟通非常重要,从取材标本到病理诊断完成病理医生与内镜医生在各个环节都应紧密合作,才能保证诊断的正确性。双方除了在日常工作的合作沟通外,还应定期进行疑难病例读片会,对疑难病例和特殊病例分析总结,并学习探讨内镜诊治和病理诊断的最新进展,不断提高早癌诊治水平。
1. 标本前期处理 病理标本在进入病理科之前,内镜医生在标本离体之后就应立即对标本进行规范化处理。
A. 活检标本的规范化处理是随后一系列病理工作的基础,应该离体后立即投入中性福尔马林中进行2-6小时标本固定,否则标本干枯变质会导致病理诊断失误,甚至无法诊断。
B. ESD标本
» 标本离体后应将其充分伸展并进行仔细固定:黏膜肌层与黏膜固有层垂直用不锈钢细针固定,否则会造成取材定向困难,镜下无法对切缘准确评估或评估失误。
» 进行口侧、肛侧以及前后壁等相应定位并进行标记。
» 确保将标本完全浸泡于中兴福尔马林液体中固定。
» 分次剥离标本务必进行准确体外拼接,每块标本按照上述要求细针固定并定位标记后进行充分固定。
2. 标本后期处理 标本在送至病理科后,应按照规范对标本进行处理。
A. 活检标本
››取到黏膜平滑肌的黏膜标本,容易肉眼认清黏膜面并进行标本定向。取材时根据实际情况确定几块胃粘膜取成一个蜡块,原则是2块胃粘膜一个蜡块。
››单独一个脱水机进行脱水处理,标本定向包埋并连续切片,最大限度保留诊断信息。
››HE规范化染色:保证染色质量,做到对比度分明,有利镜下诊断。
B. ESD标本
» 务必将送检标本全部取材
» 取材原则:a. 准确定位标记:口侧、肛侧,前壁和后壁 b. 取材方向与病变距离切缘最近的连线平行,确保将最近切缘置于最明显的显微镜视野中。
» 基底切缘与定位切缘进行不同颜色染料标记。
» 间隔2-3mm进行连续全部取材
» 画出示意图并进行取材方向、取材数量标记和切缘标记等,便于病理诊断时进行病变模拟图对应标记,有利于内镜医生更好的对应了解病变情况。
3. 病理诊断
(一)诊断标准:a.活检标本或ESD标本的瘤变或早癌按照WHO标准或维也纳标准(按照实际情况也可参考日本标准),以便与临床内镜医生进行治疗。b.病理诊断一定要与内镜医生密切合作,结合内镜下所见,尤其是放大内镜所见进行诊断。
(1)组织学分型
癌前病变(异型增生)
浸润性腺癌
(2)肿瘤侵犯的深度(SM1 ),尤其肿瘤侵犯粘膜下层(SM1)时,要进行准确测量粘膜下浸润深度,评估是否适合ESD治疗。以下粘膜下侵润深度是ESD适应症:
胃: <500μm
食管:<200μm
结肠:<1000μm
(3)脉管有无侵犯
(4)粘膜标本的手术切缘状态
(5)粘膜病变有无溃疡的判断
(6)其他病变
(7)绘制粘膜病变谱系图
(二)病理报告内容
(1)组织学分型
癌前病变(异型增生、瘤变)
浸润性腺癌(粘膜内癌, 侵犯黏膜肌或黏膜下层)
(2)肿瘤范围:
面积
侵犯的深度(SM1-ESD适应症 )
胃:<500μm
食管:<200μm
结肠:<1000μm
(3)脉管有无侵犯,根据实际情况可进行D2-40和CD31免疫组化染色
(4)粘膜标本的手术切缘状态
(5)粘膜病变有无溃疡及溃疡瘢痕形成
(6)周围病变情况及其他病变
(7)绘制粘膜病变模拟图
(三) 病理诊断协作
1. 定期进行临床+病理模式的病例读片讨论,不断规范临床病理诊断。
2. 定期进行消化道早癌最新进展学术讨论,跟踪最前沿发展动向。
3. 协作单位间定期进行巡回室间质控学习,取长补短,共同进展。
(四) 病理科研合作
1. 与临床内镜中心密切合作,建立严格的临床和病理随访机制,严密随访早癌患者,做好资料积累工作。
2. 病例资料共享,定期交流各个协作单位消化道早癌诊断情况及特点。
3. 总结山东消化早癌区域分布特点、病变特点以及流行病学等特点和免疫学特点,申请相关省级以上课题。
4. 相关成果发表中文和英文论文,署名按协作单位贡献率排名。

